
特发性肺纤维化(IPF)的诊断很大程度上依赖于侵入性操作,相应的组织学评估通常都是主观且半定量的,难以避免对患者造成伤寒。最近研究表明miRNA-21和miRNA-155含量与IPF进展呈正相关,因此联合检测miRNA-21和miRNA-155不仅可以提高IPF的诊断效能和预后评估,而且可以帮助临床制定更有效的治疗策略。鉴于miRNA的低丰度和序列同源性高,海南医学院团队开发了基于滚环放大(RCA)技术和表面增强拉曼光谱(SERS)的完全集成的微滴分析平台,用于同时检测IPF患者血清中的miRNA-21和miRNA-155。
如图1所示,从IPF患者静脉取血后,提取总RNA后输入传感芯片中。传感核心是用于RCA的挂锁探针(padlock),其上有三个功能区,分别是在用于与miRNA识别杂交的两端域(蓝色),用于与SERS基质——Au NP- pDNA 的杂交域,以及通过与MB-zipDNA杂交锚定实现分离的zip域。因此样品中的miRNA与padlock杂交(95℃),并在T4连接酶体系中环化,随后被MB-zipDNA捕获,并以zipDNA为引物进行RCA反应(45℃)。由于反应在微滴内进行,最终在95℃下解离zip域,并与Au NP- pDNA杂交,导致SERS信号从高减弱,因此这是一个“Turn OFF”设计。
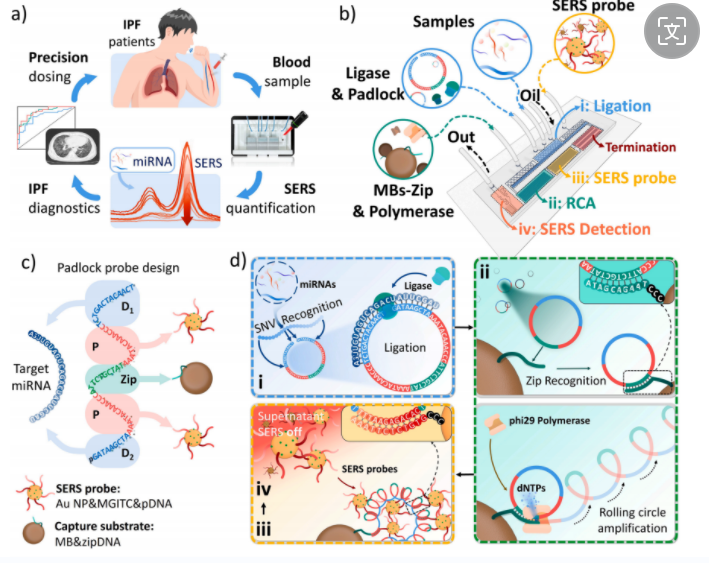
图1 用于检测IPF相关 miRNA的SERS-RCA 微流控生物传感器的原理及流程
随后作者通过电位、动态光散射验证了通过微波辅助加热法制备的Au NP- pDNA,以及通过nanodrop测试吸光度确定了单个Au NPs上可以通过金硫键偶联约266个DNA分子数,而通过SA-biotin非共价偶联效率为1:11。在成功获得两种复合物后,作者继续探究了不同的padlock设计(无二级结构),T4酶连时间(30min) phi29提供的RCA扩增时间(30min)。最后还通过TEM透射电镜观察了RCA产物与Au NPs的缠结情况。
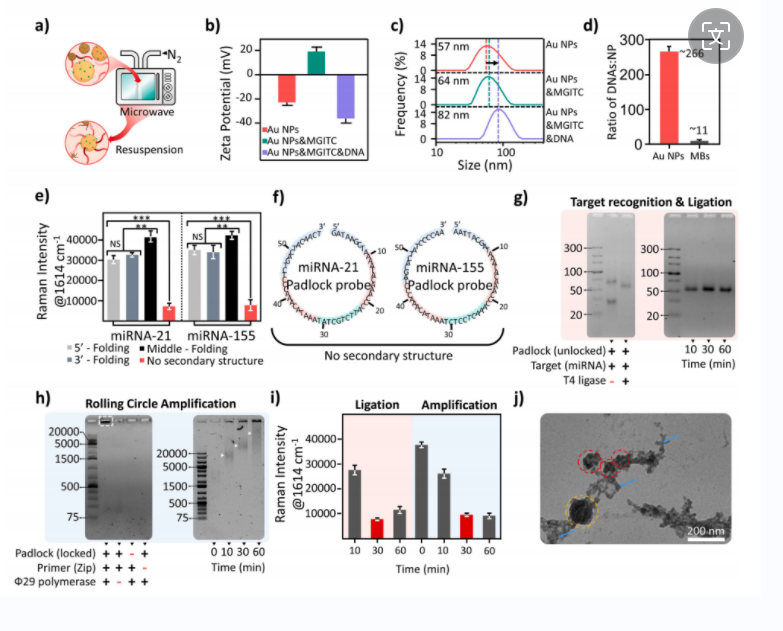
图2 可行性验证
微流控芯片由 3D 打印尼龙底座、温度可调陶瓷加热层、载玻片载体和 PDMS 层组成,检测过程包括液滴生成、混合、反应、RCA、磁分离和SERS检测。
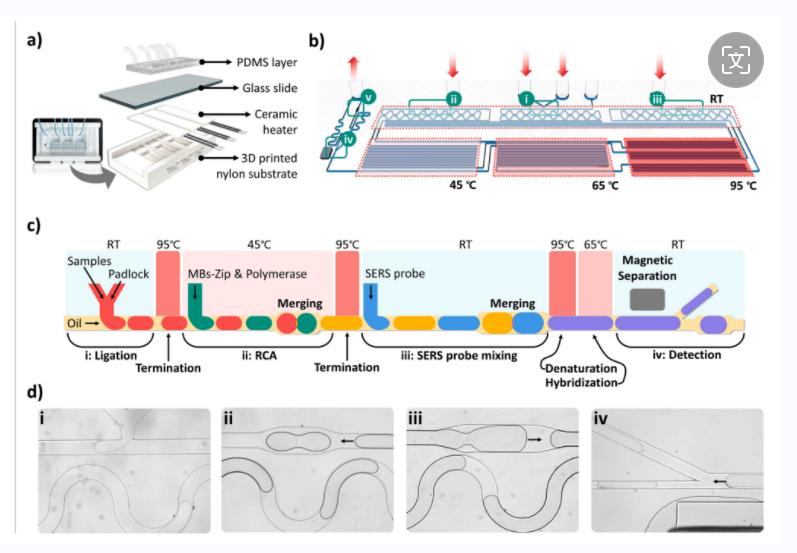
图3 微流体系统的全面表示和功能
最后作为对SERS-RCA 策略的单核苷酸变异、特异性以及其他重要的传感性能进行验证,并最终用于临床病人的有效评估。
总结:
1、全集成微流控芯片与SERS-RCA技术的创新集成提供了卓越的灵敏度、特异性、广泛的检测范围和易于操作性,超越了当前qRT-PCR和其他类似检测方法的黄金标准。2、SERS-RCA 简化了流程并最大限度地减少了昂贵试剂的使用,因此更具成本效益。3、SERS 设备和微滴泵的尺寸也阻碍了微流控小型化,这对于多样化的临床应用至关重要,未来研究亟待解决通量和设备紧凑问题。4、SERS-RCA 提供超低 miRNA 检测限和宽动态范围。5、miRNA-21 和 miRNA-155 双重检测可提高 IPF 诊断准确性(AUC:0.884)。